Seznam článků
Chelátové vazby mikroprvků:
- zcela zamezuje toxicitě kovu. Rostlina si chelát "rozbalí" jen v případě,že daný atom kovu skutečně potřebuje.
- díky nosiči tvořenému aminokyselinou jsou tyto molekuly výborně vstřebatelné
- díky efektu "klece" z organické molekuly je vyloučena možnost předávkování mikroprvků
- dostupnost mikroprvků zajišťuje v širokém rozmezí pH
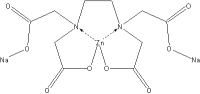
- EDTA - kyselina ethylendiamintetraoctová (vhodná k vázání Mn2+,Zn2+,Cu2+)
- DTPA - kyselina diethylentriaminpentaoctová (vhodná k vazbám Fe)
- EDDHA - kyselina ethylenediamindihydroxyphenyloctová (vhodná k vazbám Fe)
FeEDDHA
sumární vzorec:C 18 H 20 O 6 N 2Fe
Systematický název: EDDHA [ethylendiamindi( o -hydroxyphenyloctová) kyselina] ,nebo EHPG [ N, N' -ethylenbis-2-( o -hydroxyphenyl) glycin].
| Zobrazit jednotlivé struktury sloučeniny : | |
| ethylendiamin (H 2 NCH 2 CH 2 NH 2 ) | |
| fenyl [x2] (C 6 H 6 O-) | |
| kyselina octová[x2] (CH 2 COOH) nutno dopsat kód :-) | |
| glycin [x2] (NH 2 CH 2 COOH) | |
| asymetrické uhlíkové atomy v EDDHA | |
| volná rotace modelu. Po zapnutí této volby pokud budete chtít pokračovat, budete muset stránku ve Vašem prohlížeči aktualizovat! Model molekuly se postupně mění na tzv. model kalotový. |
|
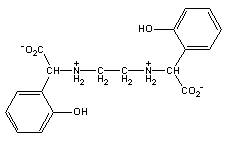
V důsledku silných vazeb mezi fenolovými skupinami a iontem Fe(III), jsou cheláty tohoto typu mnohem stabilnější než je tomu u čistě karboxylových chelatačních činidel jako je EDTA. Vazba fenol-Fe(III) způsobuje červeně purpurovou barvu složky MIKRO.
Tento model zobrazuje skoro dokonalý osmistěn, který tvoří centrální chelátovaný atom železa spolu s dvěma karboxylovými kyslíky,dvěma fenolátovými kyslíky a dvěmi aminovými dusíky na vrcholech osmistěnu (oktahedronu). Tato dokonale symetrická vazba mezi železem a jeho sousedícími vazebnými atomy je příčinnou mimořádné stability tohoto námi používaného chelátu.
Chirální uhlíkový atom váže čtyři různé funkční skupiny - tím vytváří asymetrii a dovoluje vytvořit dvě zrcadlově odlišné prostorové konfigurace. V EDDHA jsou dvě takováto asymetrická centra- proto je je cekový počet prostorových konfigurací 2 2 , neboli celkově 4 optické isomery. Díky vlasní symetrii molekuly EDDHA jsou však dvě a dvě z těchto konfigurací totožné,jsou tedy izolovatelné pouze dva isomery (ortho a meso). Směs isomerů se nazývá racemická směs(racemát). Na vzájemném poměru těchto optických izomerů je závislá celková biologická aktivita chelátu, projevující se různou mírou dostupnosti železa pro rostlinu.

